生物相容性测试
生物相容性常规三项检测指的是‘体外细胞毒性测试’‘皮肤刺激测试’‘致敏检测’等三项,这是生物相容性的常规三项,生物相容性一般指的是生命体组织对非活性材料所产生的一种性能,一般指的是材料和宿主之间的额相容性,包括了组织回相容性和血液相容性等,生物相容性既不引起生物体组织、血液的不良反应。也就是说与人类等活性本体有接触的医疗医用器械都需要做此类测试。
生物相容性常规三项办理周期:为7-8周左右(致敏就要4-6周)。
生物相容性检测常规三项:细胞毒性试验、致敏试验、刺激试验

1)细胞毒性-- 是所有医疗器材都必须做的测试。
①主要参考标准:医疗器械生物学评价第5部分:体外细胞毒性试验。(国标使用的标准是GB/T 16886.5-2003)。
②仪器设备:高压灭菌器、恒温摇床、钢直尺、电子天平、CO2培养箱、倒置显微镜、超净工作台、酶联免疫检测仪等。
③实验浸提液:含10%胎牛血清的MEM浸提(阴性对照样品)
④试验受体:小鼠成纤维细胞
2)皮肤刺激-- 人体接触的医疗器材可能会释放造成皮肤 、黏膜、或眼睛刺激反应的化学物质。简单的说,这些刺激的现象是因为局部皮肤的发炎而造成红肿、甚至发热和疼痛的感觉。许多的化学物质都能造成实时的或者是慢性的刺激反应。这些化学物质包括医材的添加物、制程或生产的催化剂、或是不小心污染的物质。譬如说:因环氧乙烷灭菌后所残留下的物质若没有降低到一定的程度就会造成人体的刺激反应?又如清洗医疗器材用的清洁液若没有适度的去除也会对使用者或病患造成意外的刺激反应。
①主要参考标准:ISO 10993-23:2021医疗器械生物学评价 第23部分:刺激试验(国标使用的标准是GB/T 16886.10-2017)。
②仪器设备:电子秤、欧式大容量恒温培养振荡器、钢直尺、立式压力蒸汽灭菌器。
③实验浸提液:0.9%氯化钠注射液(阴性对照样品)
④试验受体:新西兰兔
3)致敏试验-- 过敏通常是因为重复或长期的与化学物质接触而引起系统的反应。由于人体对于医材的过敏反应多是经由皮肤细胞接触所造成的,所以实验室中动物皮肤则被用来做过敏的测试。动物皮肤的红肿情形则用来判定过敏反应的依据。
①主要参考标准:ISO 10993-10:2021 医疗器械生物学评价第10部分:致敏试验 (国标使用的标准是)。
②仪器设备:电子秤、欧式大容量恒温培养振荡器、钢直尺、立式压力蒸汽灭菌器、电子天平。
③实验浸提液:芝麻油(阴性对照样品)
④试验受体:豚鼠
3. 测试周期:4-6周
4. 实验样品:常规是由申请单位提供并以邮寄方式提供。
5. 测试结果的判断:常规来说测试用的是新西兰兔或者是豚鼠来检测实验样品浸提液与试验系统直接接触引起的皮肤刺激/致敏反应,并类推到人类,但,实验结果并不代表样品真正的皮肤刺激反应危险性。
| 生物相容性测试项目: | ||
| 体外细胞毒性试验 | 鼠伤寒沙门氏菌回复突 | 变试验 |
| 致敏试验 | 基因突变试验 | 血栓形成试验 |
| 皮肤刺激试验 | 皮内刺激试验 | 凝血试验 |
| 急性全身毒性试验 | 亚急性全身毒性试验 | 血小板粘附试验 |
| 补体激活试验 | 亚慢性全身毒性试验 | 慢性全身毒性试验 |
| 肌肉植入试验 | 溶血试验 | 热源试验 |
| 染色体畸变试验 | 骨植入试验 | 骨髓微核试验 |
| 材料特征分析 | 皮下植入试验 | |
1.生物相容性测试及测试项目
生物相容性是指生物材料在机体特定部位产生各种复杂的生物、物理、化学的反应,即某些材料或者药物与人体接触或者植入体内是否能够“兼容”,会不会对我们的人体产生伤害。需要做生物相容性测试的产品一般是医疗器械以及医疗药物,生物相容性测试也称医疗器械生物学评价,对医疗器械产品进行有安全性和有效性评价是产品进入临床试验前的关键环节,同时也是产品上市后市场销售情况的关键所在。
生物相容性测试项目比较多,主要有细胞毒性、致敏、刺激、全身毒性(急性毒性)、亚慢性毒性(亚急性毒性)、遗传毒性、植入、慢性毒性、致癌性、生殖和发育毒性和生物降解等。不是所有的医疗器械产品都要做全套的测试项目,企业只需要根据自身产品的使用特点,结合与人体接触的部位和时间长短,查找符合自身产品的项目进行评价就可以了。实际上,对接触人体皮肤、粘膜和损伤表面等风险等级较低的医疗器械来说,需要进行试验的三个项目是:体外细胞毒性试验、皮肤致敏性试验、刺激试验,也称生物学评价的基础三项。当产品与人体长期接触或者接触部位风险较高的情况下,产品才需额外增加亚急/慢性毒性、遗传毒性、植入等试验。国标ISO10993-1:2018发布后,生物相容性测试参考项目发生了变化,具体测试项目见下表(红色:新增项目)。
| 无源 | 生物相容性检测标准: | ||
| 序号 | 项目 | 标准 |
| 1 | 体外细胞毒性试验 | ISO10993-5,GB16886.5 |
| 2 | 致敏试验 | ISO10993-10,GB16886.10 |
| 3 | 皮肤、皮内、口腔粘膜测试试验 | ISO10993-10,GB16886.10 |
| 4 | 刺激试验 | ISO10993-23 |
| 5 | 急性全身毒性试验 | ISO10993-11,GB16886.11 |
| 6 | 亚急性全身毒性试验 | ISO10993-11,GB16886.11 |
| 7 | 亚慢性全身毒性试验 | ISO10993-11,GB16886.11 |
| 8 | 慢性全身毒性试验 | ISO10993-11,GB16886.11 |
| 9 | 热源试验 | ISO10993-11,GB16886.11 |
| 10 | 染色体畸变试验 | ISO10993-3,GB16886.3 |
| 11 | 微核试验 | ISO10993-3,GB16886.3 |
| 12 | 基因突变试验 | ISO10993-3,GB16886.3 |
| 13 | Ames试验 | ISO10993-3,GB16886.3 |
| 14 | 血栓形成试验 | ISO10993-4,GB16886.4 |
| 15 | 凝血试验 | ISO10993-4,GB16886.4 |
| 16 | 血小板粘附试验 | ISO10993-4,GB16886.4 |
| 17 | 补体激活试验 | ISO10993-4,GB16886.4 |
| 18 | 溶血试验 | ISO10993-4,GB16886.4 |
| 19 | 肌肉植入试验 | ISO10993-6,GB16886.6 |
| 20 | 皮下植入试验 | ISO10993-6,GB16886.6 |
| 21 | 骨植入试验 | ISO10993-6,GB16886.6 |
| 22 | 材料特征分析 | ISO10993-18 |
| ... | ... | ... |

2.生物相容性测试标准及流程
目前生物相容性测试所参照的标准是ISO10993和GB/T16886,两种标准的内容基本一致,主要测试项目有以下几个部分:见下表。
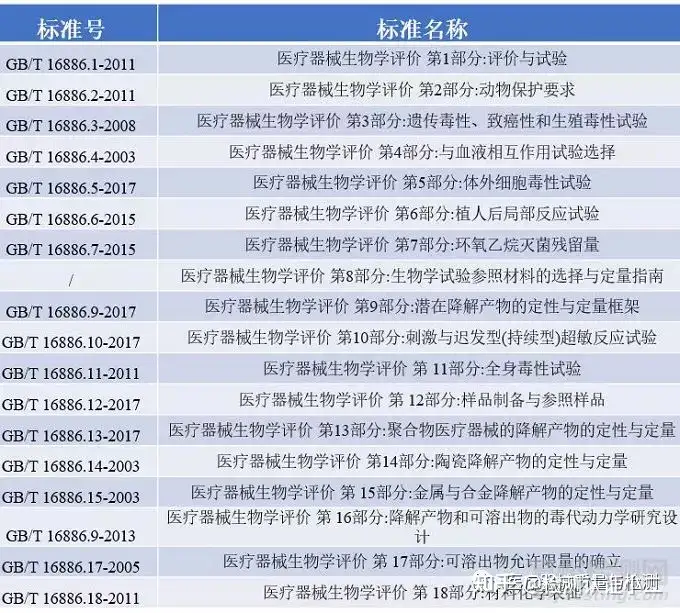
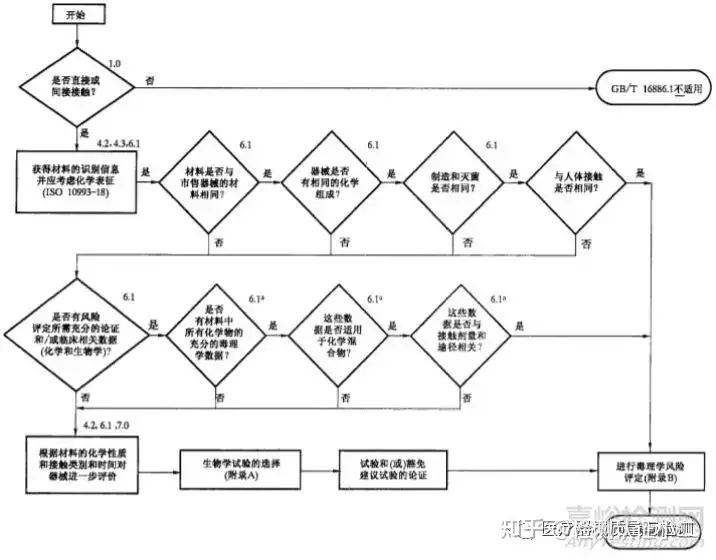
ISO10993和GB/T16886标准对具体的生物学评价过程进行了规定,在进行生物相容性试验之前需要鉴别材料成分,并做化学表征测试。体外诊断产品并不和人体直接接触,ISO10993和GB/T16886标准不适用于此类产品,其他与人体直接接触的有源医疗器械和无源医疗器械的安全性评价都需按照以下流程图进行测试。
医疗器械生物学评价流程图
3.生物学评价试验的特点及评价原则
1)大部分体内、体外生物学试验检测样品在规定的浸提条件下浸提,进行试验。
2)直接用材料和医疗器械植入体内,与组织、血液或体表组织、血液接触进行试验,大部分的体内试验是通过外科无菌手术操作方式进行的。
3)进行体外细胞培养,观察样品的细胞毒性,测定浸提液或材料对细胞溶解(细胞死亡)、抑制生长的毒性作用。
4)致癌试验是用不同形状、大小、表面状态的材料植入体内某一部位,观察动物整个寿命期材料和医疗器械对体内潜在的致癌作用。
5)血液相容性试验是通过材料和医疗器械直接接触血液,首先观察对血小板激活、血栓形成的凝血作用,其次观察血浆蛋白、血液有形成分和补体系统、细胞因子的作用。
6)植入试验是将生物材料和医疗器械埋入动物体内某些部位,埋入不同时间材料对局部的组织病理学的改变。
7)降解试验是采用各种体内外方法,测定材料和医疗器械的降解程度、力学强度的变化,了解降解产物在体内的吸收、分布、代谢过程,评价材料对机体的有害作用。
生物相容性测试遵循的两大原则有生物安全性原则和生物功能性原则。生物安全性原则的目的在于消除生物材料对人体器官的破坏性,比如细胞毒性和致癌性。生物材料对于宿主是异物,在体内必定会产生某种应答或出现排异现象,因此要对生物材料进行生物安全性评价,确保材料被宿主接受,不产生有害作用。生物功能性原则是指在特殊应用中“能够激发宿主恰当地应答”的能力,不仅要对生物材料的毒副作用进行评价,还要进一步评价材料对生物功能的影响。
4.生物学评价发展趋势
传统的生物学评价主要内容和手段是在细胞和组织水平上,利用形态学的检测方法观察材料与机体短期和长期的相互作用,随着新型医疗器械和生物材料的迅速发展,器械或材料的组成形态、植入部位及用途日趋复杂,对器械或材料的评价相应提出了更高的要求,发展快速,特异,系统的评价体系至关重要。分子生物学先进检测手段的应用使生物学评价向细胞和分子水平迈进,发展体外实验,采用灵敏,特异,先进的检测手段,优化并减少实验动物数量,建立器械和材料对分子、细胞、机体相互作用的系统性评价是医疗器械和生物材料生物学评价的最终目的。
机构名称:医疗器械第三方检测机构(报告单位拥有CNAS资质,国家级CMA资质,药监局直接认可报告)
联系方式:何工 130-4935-4532,QQ:527687553
关于我们:我们是一家综合性的医疗器械第三方检测认证机构,提供医疗设备的检测、信息咨询、注册代理等。优势项目:电磁兼容EMC检测,YY9706.102-2021检测,安全安规检测,GB9706.1-2020检测,软件安全测试GB/T25000.51-2016检测,网络安全检测、漏洞扫描、白盒测试,性能及各种专用标准检测,环境试验 GB/T14710-2009等,各大省所直接认可检测报告,医疗器械产品注册检验报告(加盖国家级CMA资质章,药监局认可),保障医疗产品的全生命周期服务……
