床头监护仪可以在第三方机构进行型检吗?
解答:可以的,但是需要机构有CMA资质,具有承检能力。

本指导原则旨在为注册申请人对病人监护产品注册申报资料的准备及撰写提供参考,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料,应在遵循相关法规的前提下使用本指导原则。
本指导原则是对产品的一般性要求,申请人应依据其具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据其具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本指导原则适用于《医疗器械分类目录》(国药监械〔2002〕302号)中第II类无创监护仪器类产品,类代号为6821。本指导原则不适用于第III类病人监护产品。
本指导原则可能不适用于所有监护仪。有关“血压监护设备、脉率描记设备、用于救护车遥测急救或医院以外动态监护仪器或系统、为后续分析储存心电数据的动态监护设备、其他类似监护的功能和功能是为触发其他仪器的采集的设备、母亲胎儿监护、遥测监护、中央监护系统”不包含在本指导原则。
二、技术审查要点
(一)产品名称要求
病人监护产品的命名应符合国家关于医疗器械命名规则的要求,例如:病人监护仪、病人监护系统等。
产品名称中不得存在型号规格描述,不得使用XX系列、XX型。
(二)产品的结构和组成
产品一般为台式或移动式,主要由主机、功能和附件组成,附件可以包括各类电极、传感器(如:心电导联电缆、血压袖带、血氧探头、体温探头、呼吸末二氧化碳气体测量组件等外接配件)。
可按设计、型式、技术参数、附件附加功能等不同分为若干型号;具有心电、无创血压、血氧饱和度、体温、呼吸、脉搏等监护单元(有些多参数患者监护设备还具有其他参数的检测功能;如:呼吸末二氧化碳)。一般采用模块式或预置式结构。产品图示举例如下:
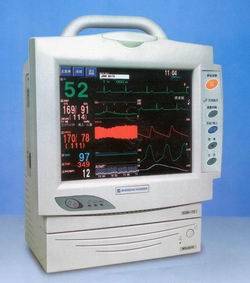
图1 多参数床边监护仪

图2 无创血压袖带
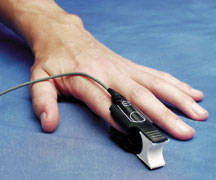
图3 血氧饱和度传感器

图4 体温探头
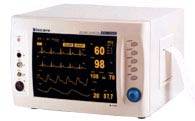
图5 多参数患者监护设备
图6 一次性使用心电电极

(三)产品工作原理/作用机理
病人监护产品包含不同生理监护单元,可对一个患者同时进行多个生理参数的监护。一般心电测量采用目前临床上广泛使用的Ag/AgCl电极测量方法。无创血压测量采用振荡法,测出收缩压、平均压和舒张压、脉率值。呼吸测量采用胸阻抗法;呼气末二氧化碳浓度的测量则是利用CO2能吸收4.3μm波长的红外线原理,在呼出气体通路上,一侧用红外线照射,另一侧用传感器测出所接收红外线的衰减程度,依据红外光吸收率与二氧化碳浓度相关的原理测出CO2浓度。体温测量采用热敏电阻法或者通过探测器测量被测对象耳腔之间的红外辐射来显示被测对象的体温。脉搏氧饱和度测量采用双波长脉动法。
(四)产品适用的相关标准
目前与病人监护产品相关的常用标准如下:
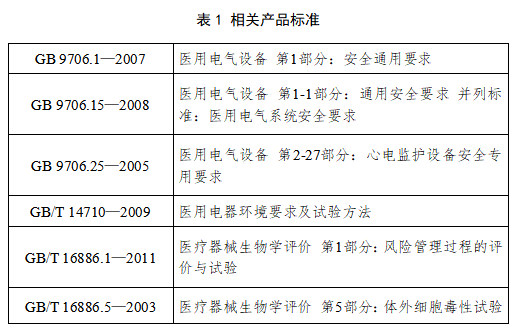
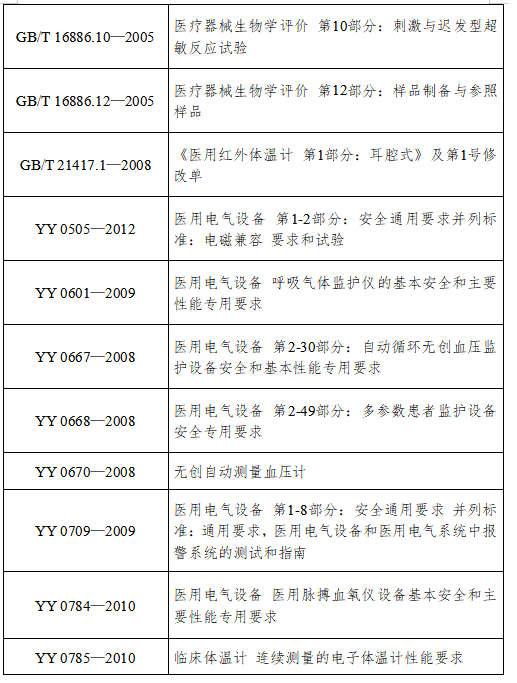

主要的审查要点包括:
(1)与产品有关的安全性特征判定可参考YY/T 0316—2016的附录C;
(2)危害、可预见的事件序列和危害处境判断可参考YY/T 0316—2016附录E、I;
(3)风险控制的方案与实施、综合剩余风险的可接受性评价及生产和生产后监视相关方法可参考YY/T 0316—2016附录F、G、J。
多参数患者监护设备的初始可预见性危害主要存在于产品的设计、生产和使用环节。如产品设计方面的初始可预见危害主要有:电能危害、生物不相容性(如应用部分的与患者直接接触的材料等)、检测和报警参数的范围和精度设置,等等;生产方面的初始可预见危害主要有:不合格材料、部件的非预期使用(采购或供方控制不充分),部件焊接、粘合和连接的不完整(制造过程控制不充分),等等;使用的初始可预见危害有:未限制非预期使用,未限制使用环境及人员,未告知正确使用、维护、保养设备的方法等导致设备不能正常使用等。
机构名称:医疗器械第三方检测机构(报告单位拥有CNAS资质,国家级CMA资质,药监局直接认可报告)
联系方式:何工 130-4935-4532,QQ:527687553
关于我们:我们是一家综合性的医疗器械第三方检测认证机构,提供医疗设备的检测、信息咨询、注册代理等。优势项目:电磁兼容EMC检测,YY9706.102-2021检测,安全安规检测,GB9706.1-2020检测,软件安全测试GB/T25000.51-2016检测,网络安全检测、漏洞扫描、白盒测试,性能及各种专用标准检测,环境试验 GB/T14710-2009等,各大省所直接认可检测报告,医疗器械产品注册检验报告(加盖国家级CMA资质章,药监局认可),保障医疗产品的全生命周期服务……
