电动抽吸机型式试验报告_第三方注册检验机构_国家级CMA资质
解答:我公司拥有电动抽吸机的国家级CMA资质,一般该产品适用于YY9706.102-2021,GB9706.1-2020,GB/T14710-2009等标准,我们是国家级CMA资质检验机构,型式试验,委托检验,注册检验,首次注册检验报告,延续注册检验报告,变更注册检验报告,出具的第三方委托检测报告可直接用于医疗器械注册或备案,无需排队,欢迎来电咨询!

呼吸机注册审查指导原则(2023年修订版)
本指导原则旨在指导注册申请人对呼吸机注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对呼吸机的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于呼吸机,按照《医疗器械分类目录》,管理类别为第三类,分类编码为08-01-01治疗呼吸机、08-01-02急救和转运呼吸机、08-01-03高频呼吸机、08-01-04家用呼吸机(生命支持)。
二、注册审查要点
(一)监管信息
1.产品名称
按照《医疗器械分类目录》《医疗器械通用名称命名规则》,呼吸机的产品名称一般以“呼吸机”为核心词,可按照产品分类、预期用途、使用场景等增加特征词,例如:无创呼吸机、新生儿呼吸机、急救和转运呼吸机。
2.注册单元划分原则
2.1不同品种的呼吸机划分为不同的注册单元。例如治疗呼吸机、依赖呼吸机患者使用的家用呼吸机、急救和转运用呼吸机等划分为不同的注册单元。
2.2技术原理不同的呼吸机划分为不同的注册单元。例如,气动电控呼吸机与电动电控呼吸机划分为不同的注册单元,高频喷射呼吸机与高频振荡呼吸机划分为不同的注册单元。
2.3配合呼吸机使用的通用性无源耗材与呼吸机划分为不同的注册单元,例如呼吸管路、气管插管、面罩等。
2.4湿化器、空气压缩机等有源医疗器械或设备原则上与呼吸机划分为不同注册单元。
2.5技术原理相同、产品设计结构的不同对安全有效性有影响的呼吸机原则上划分为不同的注册单元,例如气路设计差别较大的呼吸机。
(二)综述资料
1. 产品描述
1.1器械及操作原理描述
描述产品的工作原理、结构组成(含配合呼吸机使用的附件)、主要功能及其组成部件(关键组件和软件)的功能,以及区别于其他同类产品的特征等内容。
提供产品工程图和关键组件工程图。如果是变更注册,提供变更关键组件工程图。工程图包含三维爆炸图、二维投影图,应标注出长宽高尺寸。
结合图示描述产品的物理尺寸、重量、外观、型号和与产品配合使用的附件等信息。
提供产品的气路原理图、硬件结构图。结合气路原理图和硬件结构图对主要功能的工作原理和技术实现进行描述。
产品的主要功能(如适用)包括但不限于:潮气量输送、吸气压力控制、氧浓度控制、呼气末正压(PEEP)和[敏感词]限制压力的控制、潮气量监测、气道压力监测、氧浓度监测、报警等。
提供产品关键部件的信息,其应包括型号、规格等内容,用来[敏感词]识别这些关键部件。关键部件包括电源模块、各种传感器等。
提供电池的类型、容量和电池短路和超温的保护原理,以及认证信息等信息。
说明产品的各项呼吸模式,给出相应的定义,提供相应的呼吸波形,包括窒息通气模式(备用通气)。说明与各通气模式相关的控制参数及其含义。
说明产品的软件功能,描述各功能的原理和算法、临床应用场景、设计依据及理论基础。
产品组成示例:
本产品由主机、台车、支撑臂和附件组成。附件包括氧浓度传感器、二氧化碳传感器、脉搏氧饱和度传感器。
附件以列表形式给出,列明附件的型号、规格等信息。
工程爆炸图示例:
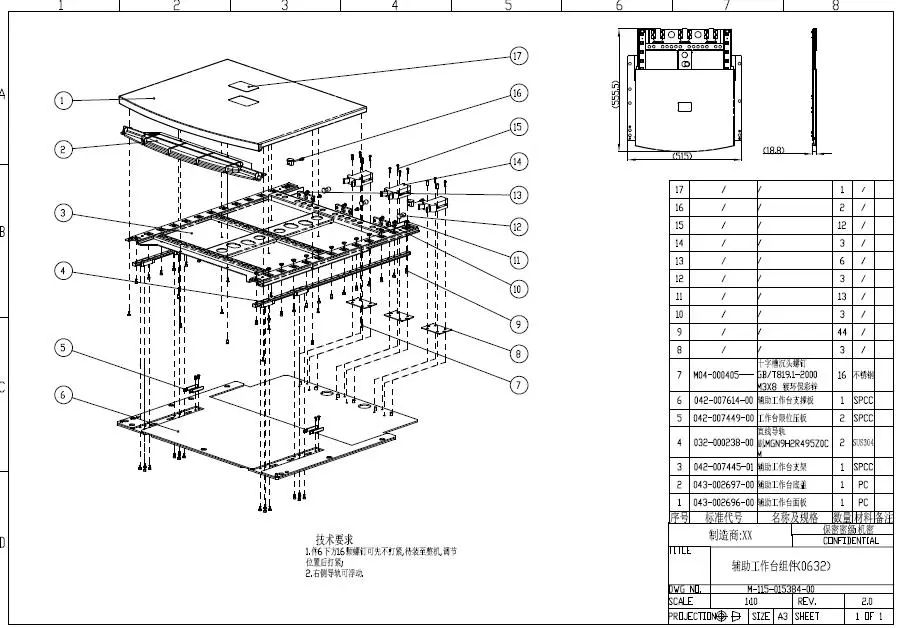
图1 工程爆炸图示例
1.2型号规格
对于存在多种型号规格的产品,按照上述产品描述的要求,明确各型号规格的区别。采用对比表及带有说明性文字的图片、图表,对所有拟申报型号规格的结构组成(或配置)、功能、产品特征和运行模式、性能指标等方面进行描述。
例如,某呼吸机产品有V01和V02两个型号,其型号规格说明举例如下:
表1 型号规格差异
|
序号 |
功能项目 |
呼吸机 |
||
|---|---|---|---|---|
|
V01 |
V02 |
|||
|
1 |
通气模式 |
容量控制/辅助通气 |
● |
● |
|
压力控制/辅助通气 |
● |
● |
||
|
同步间歇指令通气 |
● |
● |
||
|
持续气道正压/压力支持通气 |
● |
○ |
||
|
压力调节容量控制通气 |
● |
○ |
||
|
…… |
…… |
…… |
||
|
2 |
监测 |
潮气量 |
● |
● |
|
分钟通气量 |
● |
● |
||
|
气道压力 |
● |
● |
||
|
呼气末正压 |
● |
● |
||
|
氧浓度 |
● |
● |
||
|
呼吸频率 |
● |
● |
||
|
阻力 |
● |
○ |
||
|
顺应性 |
○ |
○ |
||
|
…… |
…… |
…… |
||
|
3 |
特殊功能 |
增氧 |
● |
● |
|
雾化 |
● |
● |
||
|
吸气保持 |
● |
○ |
||
|
吸痰 |
○ |
○ |
||
|
内源性PEEP显示 |
○ |
× |
||
|
…… |
…… |
…… |
||
|
4 |
结构组成 |
台车 |
● |
● |
|
二氧化碳模块 |
○ |
○ |
||
|
…… |
…… |
…… |
||
|
5 |
性能指标 |
|||
|
…… |
…… |
…… |
||
|
注:本表中●表示标配,○表示选配,×表示不配置。 |
||||
2.适用范围
明确呼吸机适用的医疗阶段、使用环境、目标用户,以及操作或使用该产品应当具备的技能/知识/培训。
例如,08-01-01的呼吸机预期在专业医疗机构内的重症治疗环境中使用或在专业医疗机构内进行患者转运,预期由培训合格获得授权的医务人员进行操作,应用于依赖机械通气的患者,属于生命支持设备。同时应明确设备适用的环境条件(温度、湿度、海拔等)、目标患者人群的信息(如成人、儿童、婴幼儿或新生儿)。如适用,还应明确说明适用患者的体重情况或者通气量情况(如体重30 kg以下的儿童)。
急救和转运呼吸机一般用于院外急救和转运环境。家用呼吸机可用于家庭护理环境。
家用呼吸机一般可由无经验的操作者进行操作,应明确操作或使用该产品应当具备的技能/知识/培训。
可用于磁共振环境的呼吸机,明确磁共振环境条件。不可用于磁共振环境无需在注册证中体现。
适用范围示例如下:
本产品预期在专业医疗机构内部的重症监护环境,或在专业医疗机构内部进行转运时使用,对成人、儿童及婴幼儿患者进行通气辅助及呼吸支持。本产品应由培训合格获得授权的医务人员进行操作。
3.禁忌证
如适用,应当明确说明该呼吸机不适宜应用的某些疾病、情况或特定的人群。
4.其他需说明的内容
4.1明确预期与申报产品联合使用的其他医疗器械、非医疗器械产品的详细信息,如湿化器、雾化器、呼吸管路、传感器、空气压缩机等,说明其制造商、型号规格、关键技术参数等。提供图示说明系统各组合设备间存在的物理、电气等连接方式。
4.2已取得注册证的部件,提供注册证信息。
(三)非临床资料
1.产品风险管理资料
按照GB/T 42062《医疗器械 风险管理对医疗器械的应用》标准的要求,针对呼吸机的安全特征,从能量危害、生物学和化学危害、操作危害、信息危害等方面,对产品风险进行全面分析并阐述相应的控制措施,风险管理报告及相关资料的要求可参考附件1。
2.产品技术要求及检测报告
按照《医疗器械产品技术要求编写指导原则》编制产品技术要求。
产品涉及的相关标准见附件2。产品技术要求及相关资料的要求可参考附件3。
3.研究资料
3.1性能研究
针对产品的功能性能、安全要求(富氧防火、单一故障安全等)等,提供相关研究资料。
3.1.1说明产品的各项技术参数,包括控制参数、监测参数、报警参数等参数的调节或监测(包括显示)范围及其误差要求。 提供各项技术参数的确定依据、所采用的标准或方法、采用的原因及理论基础。
3.1.2对产品的特殊功能和其他功能进行验证,提交验证报告。针对各功能,分别明确相关评价指标及其选取理由,说明评价指标的可接受准则及制定依据。验证报告应包括验证方法、验证结果及结论。
按照GB 9706.212第201.12.1.104条款进行氧浓度增加的响应时间验证,提交相关验证报告。
如适用,提供漏气补偿、顺应性补偿和插管补偿的设计原理和验证资料。
具有高流量氧疗功能 的产品可参考《高流量呼吸治疗设备注册审查指导原则》提交相关研究资料。
3.1.3若申报产品的压力、潮气量等控制参数的可设置范围显著超出了临床需求范围,提交相应人因设计研究资料。
3.1.4对于可通过使用患者生理参数调节通气治疗设置的呼吸机,提供生理闭环控制的研究资料,包括但不限于:对生理闭环控制的应用场景、可进行的操作等情况进行说明,描述功能的原理和算法、设计依据及理论基础。重点关注生理变量、被控变量等风险并阐述相关控制措施。在说明书中明确生理闭环控制的使用场景及限制,并提供相关警示信息。还应提供生理闭环控制的验证资料。
3.1.5若产品可用于磁共振环境,描述具体的磁共振环境使用条件,如磁共振设备类型、磁场强度限制、产品放置位置、距离、产品通气模式及配置要求等。对产品在磁共振环境中能否正常运行(包括控制、监测和报警)、产品对磁共振设备的影响(如成像质量等)开展实际测试,提供相应验证报告。依据上述研究,在产品技术要求附录中明确产品的磁共振使用条件。
3.1.6对于适用的[敏感词]标准、行业标准中的不适用条款,说明不适用的理由。
3.1.7产品可与湿化器、空气压缩机等其他产品或设备联合使用的,提供联合使用的研究资料。
3.1.8参照YY/T0882的要求,提供产品与氧气兼容性的研究报告,提交相应测试计划与报告。
3.2电气系统安全性研究
提供电气安全、机械和环境保护以及电磁兼容性的研究资料,说明适用的标准以及开展的研究。
3.3软件研究
呼吸机软件一般用来控制呼吸机的运行,包括各项参数的控制、监测和报警,安全性级别归为严重。参照《医疗器械软件注册审查指导原则(2022年修订版)》《医疗器械网络安全注册审查指导原则(2022年修订版)》的要求,提供相应研究资料。
3.4生物学特性研究
说明产品预期与气体接触的部位,提交与气体接触的材料清单;说明使用的材料的基本信息,如材料的组成、成份信息、材料的物理和化学属性等,并应保证使用的材料的安全性。建议参照YY/T 1778.1等系列标准,提交产品气体通路生物相容性研究资料。
若呼吸机含有预期与人体接触的部件或附件,根据产品与人体接触部位、接触方式及接触时间,按GB/T 16886.1等系列标准的规定要求进行评价。
机构名称:医疗器械第三方检测机构(报告单位拥有CNAS资质,国家级CMA资质,药监局直接认可报告)
联系方式:何工 130-4935-4532,QQ:527687553
关于我们:我们是一家综合性的医疗器械第三方检测认证机构,提供医疗设备的检测、信息咨询、注册代理等。优势项目:电磁兼容EMC检测,YY9706.102-2021检测,安全安规检测,GB9706.1-2020检测,软件安全测试GB/T25000.51-2016检测,网络安全检测、漏洞扫描、白盒测试,性能及各种专用标准检测,环境试验 GB/T14710-2009等,各大省所直接认可检测报告,医疗器械产品注册检验报告(加盖国家级CMA资质章,药监局认可),保障医疗产品的全生命周期服务……
