体外诊断分析系统注册检验报告 GB/T18268.1和GB4793.1国家级CMA章
我司拥有国家级CMA资质,CNAS资质,YY9706.102-2021,GB9706.1-2020,GB4793.1-2007,GB/T18268.1-2010,GB/T18268.26-2010,GB/T14710-2009等标准,出具的检测报告全国医疗所认可,欢迎来电咨询!
国家级CMA资质,出具的检测报告可直接用于医疗器械注册

目前,根据我国国家食品药品监督管理局(SFDA)的《医疗器械分类目录》标准,体外诊断设备属于临床检验分析仪器类。体外诊断行业定义及分类指出,体外诊断是指在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。体外诊断产品主要由诊断设备(仪器)和诊断试剂构成。
1、按诊断方法分:临床化学分析仪器、免疫化学分析仪器、血液分析仪器、微生物分析仪器。
2、按搭配试剂分:开放式系统、封闭式系统。
3、按检验原理分:生化诊断试剂、免疫诊断试剂、分子诊断试剂、微生物诊断试剂、尿液诊断试剂、凝血类诊断试剂、血液学和流式细胞诊断试剂。
体外诊断,即IVD(In Vitro Diagnosis),是指在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。目前,IVD设备在国内临床检验方面得到了广泛的应用。为防止 IVD设备在使用中对操作人员造成触电危险,保证IVD设备的电气安全十分重要。本文就日常IVD设备电气安全检验中常见的注意事项进行了梳理、同时对可能影响电气安全风险的标签要求进行了说明。
1.标准引用
目前,IVD设备的安全要求应符合标准GB4793.1-2007(IEC 61010-1∶2001)(以下简称"GB4793.1")的规定,同时还应满足 GB 4793.9-2013(IEC61010-2-081∶2009)和YY 0648-2008(IEC 61010-2-101∶2002)的要求。对于国际标准,目前现行有效版本分别为IEC 61010-1∶2010、IEC 61010-2-081∶2015和IEC61010-2-101∶2015,其中IEC61010 -2-081∶2015中已明确说明该标准不再适用于IVD设备。除此之外,某些设备由于存在特殊功能结构,还应满足其他安全标准的要求,如∶
(1)若IVD设备含有加热元件、则该设备原则上应满足 GB 4793.6-2008要求,但对于我们常见的IVD设备,虽有加热或孵育功能,但已在 GB 4793.1中4.4.2.10加热装置或 14.3过温保护装置等相应章节做了充分测试或考察的情况下,可不采用 GB 4793.6-2008标准;
(2)若IVD设备含有离心机模块,则该设备应满足GB4793.7-2008要求;
(3)若IVD设备含有激光元件,则该设备应满足GB 7247.1-2012要求,常见于五分类血细胞分析仪、特定蛋白分析仪等设备,或配备的激光扫码器等功能附件。
检验人员应通过全面分析 IVD设备的功能以及结构,对适用的标准进行采纳并测试。
2.主要安全指标
保护连接阻抗、介电强度试验、接触电压接触电流为电气安全测试中的三大项,本章分别对这三项测试中的注意事项进行了汇总。
(1)保护连接阻抗
GB4793.1中6.5.1章节对保护连接进行了说明。测试方法的选择∶ 目前常用的阻抗测试仪有两线法和四线法两种方法,两线法不能有效地消除接触电阻和引导线电阻的影响,测试时应启用补偿功能(OFF SET)。正常情况下,四线法的接触电阻和引导线电阻的影响可以忽略,但在阻抗测试仪线路老化、测试值处于临界状态或其他精密测量时,也应考虑启用四线法的补偿功能。
测试点;标准要求在"保护导体端子与规定要采用保护连接的每一个可触及零部件之间"进行测试,我们可以理解为∶未采用保护连接的可触及部分,即使是可触及金属部分,也无需进行保护连接阻抗测试,这些测试点可采用GB4793.1中6.5.2~6.5.4章节提及的一种或多种防护措施来确保单一故障条件下的电气安全要求。另外,电源线的阻抗不构成保护连接阻抗的—部分,对于不可拆卸式电源软电线,也应扣除电源线的阻抗。
测试电流∶对于常见的可拆卸或不可拆卸电源软电线的设备,其额定电流的2倍通常小于25A,故试验电流常用25A。对于永久连接式设备,试验电流选取建筑物供电电源电路的过流保护装置额定值的2倍,或者设备内部过流保护装置额定电流的2倍(假设该设备在电源的所有极上装有过流保护装置,以及在单一故障条件下过流保护装置电源一侧的导线不可能变成与可触及导电零部件相连),两者取较小值。
测试时间∶测试时间应为 1min,通过较长时间的大电流测试, 可以在一定程度上检验被测设备的保护接地通路电流承载能力。
(2)介电强度试验
GB4793.1中6.8章节对介电强度试验进行了说明。试验电压值的计算∶试验电压值由绝缘类型、电气间隙、试验地点海拔高度等因素决定,常涉及到的表格为GB 4793.1标准中表9和表10;其中电气间隙由工作电压、额定工作海拔高度等因素决定,常涉及到的表格分别为GB4793.1标准中表4和表3。下面以常见的额定电压 AC 220V,试验地点海拔高度1~500m为例,将电气间隙以及试验电压值汇总如下,见表1。
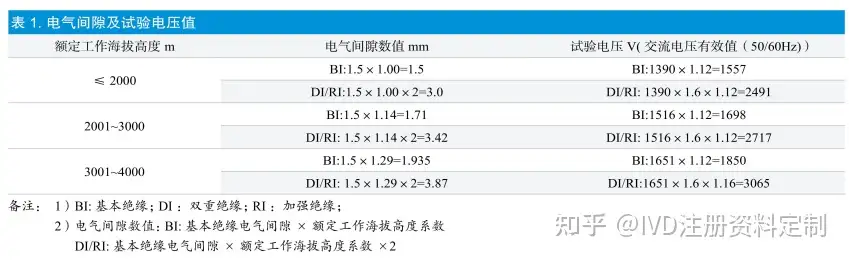
表1中的试验电压 1390V、1516V和 1651V分别由GB 4793.1中表9内插值法得到,表1仅以常见电压为例,其他情况试验电压可根据标准中相应表格推算得出。
试验前特殊要求:GB4793.1 标准中6.8.2章节要求,介电强度试验要在潮湿预处理后进行。通常情况下,,潮湿预处理后,被测设备在室内正常工作条件下恢复2h,第 3h 内进行介电强度试验。测试时间∶试验电压在 5s 以内从0V逐渐升高到规定值,然后保持5s。在此过程中,事先无需像医用电气设备 GB 9706.1-2007标准中要求的那样先将试验电压升至规定值的一半、对于日常工作中经常涉及到这两份标准的检验人员,这点容易被忽视。
其他注意事项∶介电强度试验时,被测设备不通电,但电源开关处于打开状态,以便更好地考察被测设备的绝缘情况。
(3)接触电压、接触电流
GB 4793.1 标准中的6.3章节对接触电压和接触电流的相关限值进行了介绍,但未对接触电流等术语进行定义,我们可参考相关标准GB/T 12113-2003中的定义团,并且GB 4793.1 中附录A接触电流的测试电路也同样是参考了GB/T 12113-2003标准。
测试电路的选择;GB4793.1标准中附录A给出了几种测试电路,目前IVD设备中经常会使用到开关电源等关键元件,由于内部存在高频变压器,这种情况下,使用GB 4793.1附录图 A.1的测试电路。
测试点;针对大型设备,除了进行可触及零部件对参考试验地的测试,还应考虑到1.8m 的距离内任意两个可触及零部件之间的测试。
与外部电路的连接∶对于有信号口的被测设备,测试时,应将信号口与外部的连接断开,以免接触电流经信号线导入外部设备中,使得测试值低于实际值。
其他注意事项;GB 4793.1标准中虽未对测试时供电正反向极性进行要求,但建议正反向均应测试,在实际工作中,确实存在正向与反向分别供电时,测试值差别较大的情况。若经过分析被测设备的信号口有可能接触 220V网电,或有可能在单一故障条件下网电 220V加在被测设备信号口上,则需在信号口施加 220V测试被测设备的可触及部分是否危险带电,此时的各项限值参考单一故障条件下限值。
3.标签标识
标签标识能为操作者或维护人员提供重要的指示作用,在IVD设备检验中,以下几处与电气安全相关的标识应引起注意∶
1)熔断器标识∶对于可由操作人员更换的熔断器应在熔断器座旁标注符合要求的熔断器具体规格;
2)保护接地符号∶若电源线插头中的地脚作为保护接地功能,则该地脚应含有保护接地符号
,注意与功能地符号
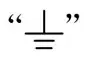
区分;
3)双重绝缘符号;全部用双重绝缘或加强绝缘保护的设备应标上

符号;
4)其他符号∶"I"和"O"仅用干主电源开关;使用
激光元器件的设备应按照GB 7247.1-2012标准的要求标识激光符号。
医疗器械检验报告需要加盖CMA章出自何处?
注册申请人提交自检报告的,若不具备产品技术要求中部分条款项目的检验能力,可以将相关条款项目委托有资质的医疗器械检验机构进行检验。有资质的医疗器械检验机构应当符合《医疗器械监督管理条例》第七十五条的相关规定。
条例第75条:医疗器械检验机构资质认定工作按照国家有关规定实行统一管理。经国务院认证认可监督管理部门会同国务院药品监督管理部门认定的检验机构(国家级CMA资质认定),方可对医疗器械实施检验。
解读说明:注册申请人应根据产品特点,对受托机构的资质、检验能力、检验范围进行评价。委托检验报告应该加盖CMA公章。若检验机构无法加盖CMA公章,应按照国家药监局综合司关于明确《医疗器械检验工作规范》标注资质认定标志有关事项的通知(药监综科外函〔2020〕746号执行。
即:对于产品技术要求完全采用国家标准、行业标准的,检验机构必须取得该国家标准、行业标准的资质认定,报告封面加盖资质认定标志CMA章,并在报告备注中注明。对于产品技术要求不涉及或部分涉及国家标准、行业标准进行检验并出具报告的,应在检验报告书备注中对承检能力予以自我声明,并承担相应的法律责任。自我声明内容为“该产品技术要求不涉及/部分涉及国家标准、行业标准,不能直接作为资质认定许可的依据,但本实验室对报告涉及的检验项目具备相应的承检能力”。这就是不能盖CMA的情况而不是说不需要CMA或者应该盖而没有盖。现在技术要求预评价这个文也已经废止了,也就是无论自检还是委托检都不需要进行产品技术要求预评价,那么,原来检测所还可以把一道关,现在也是都直接到审评这里来了,也是变相提高了对审评的要求。


机构名称:医疗器械第三方检测机构(报告单位拥有CNAS资质,国家级CMA资质,药监局直接认可报告)
联系方式:何工 130-4935-4532,QQ:527687553
关于我们:我们是一家综合性的医疗器械第三方检测认证机构,提供医疗设备的检测、信息咨询、注册代理等。优势项目:电磁兼容EMC检测,YY9706.102-2021检测,安全安规检测,GB9706.1-2020检测,软件安全测试GB/T25000.51-2016检测,性能及各种专用标准检测,环境试验 GB/T14710-2009等,各大省所直接认可检测报告,医疗器械产品注册检验报告(加盖国家级CMA资质章,药监局认可),保障医疗产品的全生命周期服务……
