血液透析用水设备检测_国家级CMA资质_现场检验资质及整改服务_第三方检测报告
解答:我司专注医疗器械检测,拥有电磁兼容、安规安全、环境可靠性、性能指标等检测能力,主要的标准有:YY9706.102-2021,GB9706.1-2020,YY 0793.1-2022,无需排队,可以上门检测服务,出具的第三方检测报告可直接用于医疗器械注册或备案。
我司是一家集检测、整改、培训、出具注册用检验报告为一体的大型综合性实验室,拥有CNAS资质和国家级CMA资质,出具的报告可直接用于:一类医用电气设备备案检验报告、二类医疗器械注册检验报告,可上门服务,欢迎来电咨询!

本指导原则旨在指导和规范血液透析用制水设备产品的技术审评工作,帮助审评人员理解和掌握该类产品的原理/机理、结构、主要风险、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
请点击此处输入图片描述
三、审查关注点
(一)应关注注册单元中,各个型号产品的工作原理、基本结构组成、技术指标、适用范围,同一注册单元产品的以上项目应基本相同。
(二)应关注产品标准中,规范性引用文件是否齐全,是否为现行有效版本。
(三)标准条款是否执行了YY 0793.1-2010和YY 0572-2005标准中的全部适用项目;对行业标准中的不适用项目是否在编制说明中进行了明确,不适用理由是否充分。

(四)产品的结构组成是否与产品类型相对应,是否有必备组件未覆盖;是否明确了与处理水接触的所有部件原材料及要求。 产品结构组成可有多种描述,从水处理工艺流程上表述,设备主要包括预处理系统、反渗透/除盐系统和可选择增设的后处理系统。具体结构组成一般应包括:预处理系统:以市政自来水为原水时,包括多介质过滤器,软化器,活性炭过滤器,保安过滤器;反渗透/除盐系统:包括一级反渗透器(一级RO泵和RO膜组件),二级除盐器(二级RO泵和RO膜组件或二级离子交换器)(注:二级除盐器为可选择设置,二级和一级没有本质区别,只是根据原水水质将一级反渗透产水再作了一次除盐);后处理系统(采用直接供水模式时不设后处理系统):包括纯水箱,紫外线杀菌器,内毒素过滤器,纯水输送泵;纯水输送管路;清洗消毒系统:包括化学消毒(含消毒剂消毒和臭氧消毒二种方式)和物理消毒(紫外线消毒和热消毒二种方式),可采用四种消毒方式中的一种或多种组合方式;控制系统(控制设备);检测仪表。
(五)应关注注册检验报告是否覆盖所有性能要求的检验,覆盖的性能指标是否为最高要求;注册检验报告所附照片中的产品结构组成、标识标签等信息,是否与其他申报资料描述相同。
(六)应关注临床试验资料中,对比同类产品的关键结构组成、工作原理、适用范围是否与申请注册产品一致。
(七)应关注产品使用说明书适用范围是否与临床结论一致,不能宣称临床试验结论以外的其他的预期用途,也不能对临床试验结论进行扩大或改变;说明书中应明确设备耗材及组件的维护频次及使用期限;说明书中所描述的产品功能应与标准性能相对应;应明确产品配套使用产品的要求,包括取得医疗器械注册证、具体型号规格等。
(八)必要时,可以要求企业提供整体设备系统说明,如:
1.系统各组件之间的联系、工作流程图、液体路径;
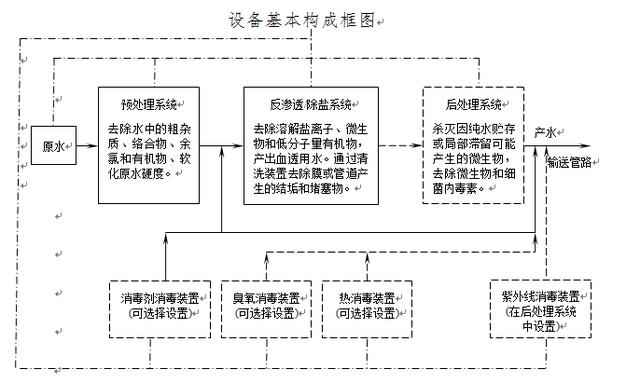
请点击此处输入图片描述
注:①虚线框内为可选择装置,点划线为设备控制网络。
②采用直接供水模式时不设后处理系统。
③设备至少采用一种消毒方式。
水处理流程示意图(箭头方向表示被处理水的流向)
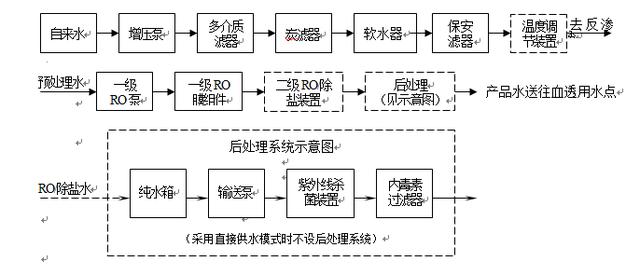
请点击此处输入图片描述
2.系统各组件的相关特定要求,包括:
2.1 反渗透(R.O.)
2.1.1 提供R.O.系统示意图,包括所有阀门的位置以及所有压力、温度、传导性/总溶解固体(TDS)和流量传感器。为了获得准确度,传导性/TDS仪表应可进行温度补偿。
RO系统示意图
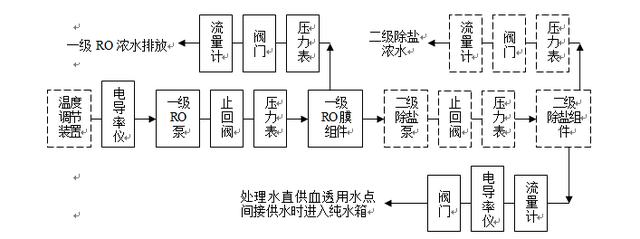
请点击此处输入图片描述
2.1.2识别所有水接触材料,从而将其与接触给水和产品水的材料分离。 一套血液透析用制水设备,从原水入口起至产品水输向使用点止,与给水接触的材料有原水箱、原水增压泵、机械滤器及其内容物、软水器及其内容物、碳滤器及其内容物、保安滤器及其过滤芯、反渗透高压泵的泵体、配套预处理的压力表、流量计、压力保护器、电导率仪传感器以及原水入水口后至RO膜进水口前的管阀件;与产品水接触的材料有RO膜、产品水箱、产品水输送泵泵体、用于后处理的直通在线臭氧杀菌器过流管、UV杀菌器过流管、细菌内毒素过滤器及其滤膜、配套后处理的压力表、流量计、电导率仪传感器以及RO膜产品水出口至产品水输向末端使用点止的管阀件。 2.1.3 提供所用滤膜的完整说明,包括物理设计和结构材料。建议提供折叠膜滤芯的示意图。根据建议的温度范围,提供渗透流速范围的示意图。
例:8英寸陶氏反渗透膜示意图及最大运行参数
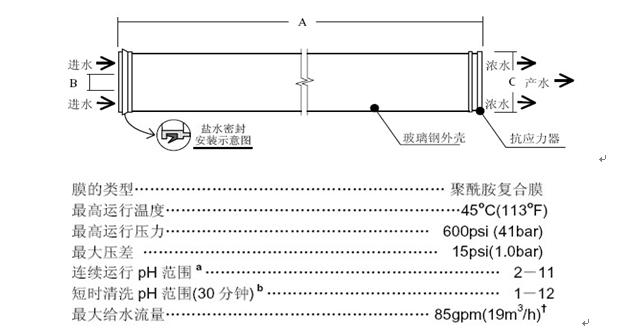
请点击此处输入图片描述
2.2去离子(D.I.)
提供器械说明,包括该系统的一般示意图、所有尺寸和供给容量(即,给水和产品流速以及特定溶解物减少的范围)以及树脂特性(包括质量)等。 经典的去离子装置是混床树脂型(DI.)。DI是通常用于一级反渗透产水的进一步去离子。为同面积下容积最大化,装置通常做成圆罐形式,径深度处理后的混床树脂填装于罐内。常用混床树脂的湿真密度(20℃)约为1.09,湿视密度约为0.75,最高允许温度OH型40℃、CL型80℃,适用PH值范围1~14,交换容量约为500毫克当量/升树脂,若一级反渗透产水的电导率值在ρ≤10μs/cm时,通常每升电子级混床树脂可深度处理200升产品水,在水温25℃~35℃,间,控制DI的允许流速在40~60m/h较为合适
2.3软水器
提供器械说明,包括容量(即,给水和产品流速)、所处理的给水硬度范围以及所有水接触材料的标识等。 软水器的内置物主要是阳离子交换树脂,经典型号为001×7,常温下工作交换容量800~1000毫克当量/升树脂,运行流速控制在15~25米/时较适宜,通常用食盐(Nacl)做再生剂;软水器的树脂量定值时,给水硬度与单位容积树脂处理有效水量成反比。
2.4碳过滤罐
提供器械说明,包括树脂床容积、最大流速、空树脂床接触时间(EBCT)以及所有水接触材料的标识等。 碳过滤罐主要起去除原水中的余氯及其他对RO膜起致命损害作用的强氧化剂,以保障RO膜正常运行。活性炭吸附余氯主要是以化学置换反应为主,该反应在常温状态下即可瞬间完成。因此,衡量碳过滤罐的效果本质上只和活性炭的内在质量(即典值)、有效孔隙率、有效比表面积直接有关,流速和空树脂床接触时间是间接反应效果的指标,如低流速和高空树脂床接触时间只能反映罐中原水与活性炭表面接触的概率和接触的时间会增加,但对已失效的活性炭而言,它所提供的表面积再大,原水与其接触再多的时间都是不会起任何过滤效果的。
2.5沉积物过滤器和筒式过滤器
提供器械说明,包括供应所有装置的尺寸、过滤容量、流速和预期压降,识别所有水接触材料等。 机械过滤器主要是物理性质的过滤。作为物理法过滤,有效滤料的粒径和滤器所设计的滤过流速致关重要,在包括原水质量、水温水压等外界条件定值时,过滤效果与有效滤料的粒径和滤器所设计的滤过流速成反比,即有效滤料的粒径和滤过流速越小,则过滤效果越好。
2.6超滤器
提供该器械的物理说明,包括流速、预期压降和结构材料。提供折叠膜滤芯的示意图。说明可能与该组件一起安装的任何监测器或报警装置等。 超滤器由超滤膜和外壳组合而成,核心是超滤膜。超滤(UF)介于纳滤(NF)和微滤(MF)之间,其规格型号通常采用截留分子量划分,可过滤20~1000埃(大于0.1微米);按结构形式分超滤器有中空纤维式、管式和平板式等,血液透析用制水设备中多用中空纤维式超滤器(所谓的人工肾就是由超滤膜做成的一种超滤器)。超滤膜的负载流速和压力与其截留分子量和结构形式有密切关系,透膜压通常在1~4 bar。折叠膜滤芯通常是微孔滤膜,微孔滤膜的规格通常是以孔径的大小区分,通常是在0.1~1微米之间。 2.7 UV消毒装置
提供器械说明,该说明包括结构材料、推荐的给水流速、UV强度和UV消毒的有效性。应包括器械示意图。说明使用的所有监测器、报警装置或控制系统,以检测指示灯辐射能量输出的损耗等。 紫外线(UV)消毒装置是物理法消毒的装置,用于产品水箱中的血液透析用水向血透机输送过程中对临床用水的杀菌。UV灯的辐射强度和消毒的有效性见YY 0793.1-2010相关规定。需要说明的是在YY 0793.1-2010相关规定条件定值时,消毒效果与UV消毒装置内产品水受辐射的过流厚度成反比,与受辐射的过流时间成正比。
2.8储水罐
提供器械说明,该说明包括储水罐尺寸以及任何级别控制器和空气过滤器的说明等。 储水罐是储存反渗透制水设备所制产品水的罐。设置该罐的最大作用是可以极大地降低反渗透水机的工作负荷,同时也可保障遇反渗透制水主机突发性故障时,在一定时间内使临床透析继续进行。为最大限度避免储水罐可能产生的二次污染,首先应重视内置水与为界空气除菌隔离,通常在顶部布置空气过滤器,滤膜精度0.22~0.45μm;再是将内部进水口设置于储水罐顶部,出水口与储水罐锅底型顶部近中成90°并布置万向喷淋洗球和水流转向导管,以便在进水的同时完成对储水罐顶盖壁面滞留雾水的冲刷,避免滋生细菌。为便于储水罐的人工清洗消毒,顶部应设置不小于Ф600的清洗人孔;排污阀应设置于锅底型底部正中最低点处。纯水箱及其配套管阀件通常采用不锈钢材质,快接连接,要求不锈钢材质不低于304。
2.9辅助组件
辅助组件包括管路、阀门、配件、量规、传感器、仪表、监测器、检测器和液泵。应提供每个组件的以下信息:
2.9.1规定结构材料。
如果在产品水管线上安装辅助组件(在R.O.或D.I.后),应提供浸滤试验的结果,以便采用适当的化学分析识别并描述接触产品水的任何材料中的析出物的特征。
2.9.2确保所有传感器、仪表、监测器、量规和检测器的准确性。
2.9.3如果传感器采用软件,应提供相关信息。
2.9.4说明所有相关报警或监测系统。
机构名称:医疗器械第三方检测机构(报告单位拥有CNAS资质,国家级CMA资质,药监局直接认可报告)
联系方式:何工 130-4935-4532,QQ:527687553
关于我们:我们是一家综合性的医疗器械第三方检测认证机构,提供医疗设备的检测、信息咨询、注册代理等。优势项目:电磁兼容EMC检测,YY9706.102-2021检测,安全安规检测,GB9706.1-2020检测,软件安全测试GB/T25000.51-2016检测,网络安全检测、漏洞扫描、白盒测试,性能及各种专用标准检测,环境试验 GB/T14710-2009等,各大省所直接认可检测报告,医疗器械产品注册检验报告(加盖国家级CMA资质章,药监局认可),保障医疗产品的全生命周期服务……
